by Tymkovych Karina
Copyright © 2022
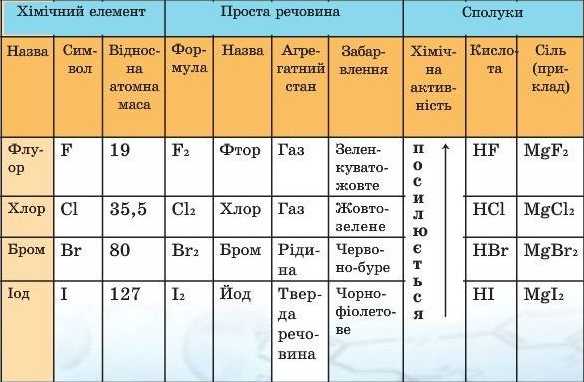
До VІІ А групи періодичної системи Д.І. Менделєєва входять Флуор 9F, Хлор 17Cl, Бром 35Br, Іод 53І та Астат 85At (стабільних ізотопів не має). F, Cl, Br, І носять назву „галоґени” (в перекладі з грецької – солероди). Ця назва зумовлена їх властивістю утворювати солі під час безпосередньої взаємодії з металами.
Назви Хлору, Брому та Іоду пов’язані з властивостями їх простих речовин (мал. 1): Хлор — за кольором (зеленкувато-жовтий), Бром — із запахом (смердючий), Іод — за кольором пари (фіалковий). Назва Флуору походить від латинського слова fluidus — плинний, оскільки добавки мінералу флюориту CaF2 до металічних руд полегшують їх плавлення. Назва радіоактивного елемента Астат грецькою мовою означає «нестійкий».



Мал. 1. Галогени: а — фтор; б — хлор; в — бром; г — йод; ґ — астат
Електронна конфігурація зовнішнього шару – ns2nр5. Зміна хімічних властивостей у ряду F – Cl – Br – І – At зумовлюється послідовним збільшенням розмірів ns-, nр-валентних орбіталей. Із збільшенням порядкового номера атома елемента зростає густина, збільшуються температури кипіння і плавлення, зростає сила галогеноводневих кислот, зменшується реакційна здатність.
Галогени – типові неметали, під дією відновників легко перетворюються в галогенід-іони Г–. Галогени енергійно взаємодіють з металами, з s-металами утворюють йонні сполуки. Йонний характер галогенідів дещо послаблюється із збільшенням порядкового номера елементу, що є наслідком зменшення електронегативності. З більш електронегативними елементами галогени проявляють позитивні ступені окиснення.
Властивості Флуору помітно відрізняються від властивостей інших галогенів. У нього відсутні вакантні d-орбіталі, електрони 2s22р5 слабо екрановані від ядра, що призводить до високої електронної густини, енергії йонізації, електронегативності. Тому для Флуора можлива лише ступінь окиснення -1, 0, а для інших галогенів -1 (максимальна стійкість сполук), 0, +1, +3, +5, +7, імовірні також +2,+4,+6).
Мал. 2. Електронна конфігурація валентних електронів атомів галогенів в основному і збудженому станах

Знаходження у природі
У земній корі вміст Флуору становить 6·10-2%, Хлору, Брому, Йоду відповідно 2·10–2; 2·10–4; 4·10–5 %. Флуор зустрічається у вигляді флуоридів (біля 30 мінералів, найбільш важливі – СаF2 (флюорит або плавиковий шпат), 3Ca3(PO4)2CaF2 (фторапатит), Na3[AlF6] – кріоліт). Хлор утворює близько 70 власних мінералів, головним чином це хлориди легких металів (кам’яна сіль, галіт NaCl; сильвін KCl, карналіт KCl MgCl2 6H2O тощо). Основна маса галогенів сконцентрована у воді морів і океанів. Бром та йод також містяться в бурових водах, морських водоростях (наприклад, в морській капусті (ламінарії) вміст йоду досягає 0,45%).

Мал. 3. Природні сполуки Флуору: а — флюорит, або польовий шпат, б — кріоліт;
Хлору: в — галіт (кам’яна сіль), г — сильвін, ґ — сильвініт, д — карналіт
Фізичні властивості
У газоподібному, рідкому та твердому стані галогени – двоатомні молекули Г2.
Фтор – світло-жовтий газ із дуже неприємним різким запахом.
Хлор – зелено-жовтий газ із різким запахом
Бром – червоно-бура важка рідина з різким запахом;
йод – чорні, металево блискучі кристали (під час нагрівання перетворюється на фіолетовий газ (сублімація) – малюнок 1.
Температури плавлення та кипіння монотонно збільшуються від фтору до йоду із збільшенням розміру молекули та підсиленням міжмолекулярної взаємодії. Усі галогени отруйні, мають характерний запах, відзначаються великою леткістю. Йод при незначному нагріванні сублімує. I навпаки, при охолодженні пари йоду знову утворюють кристали.
Загальна характеристика хімічних властивостей.
Галогени відносять до активних неметалічних елементів. Хімічна активність галогенів (атомів і молекул) спадає в ряду від Флуору до Йоду. Активніші галогени витісняють менш активні з їхніх сполук. Окисні властивості галогенів зменшуються в підгрупі від Флуору до Йоду, оскільки зростає радіус атома і здатність приєднувати електрони зменшується. Йони галогенів (Сl–, Вr–,I–) здатні віддавати електрони, а тому виявляють відновні властивості, які збільшуються від хлорид-іона до йодид-іона.
З Гідрогеном галогени утворюють леткі сполуки, які називають гідрогенгалогенідами, або галогеноводнями: HF, НСl, НВr, НІ. Це газоподібні сполуки, які легко розчиняються у воді. Їхні водні розчини є кислотами. Утворені галогенами солі називають відповідно флуоридами, хлоридами, бромідами, йодидами.
У ряду кислот HF → НСl → НВr → НІ спостерігається підсилення кислотних властивостей сполук. Це пояснюється тим, що вниз по групі спостерігається збільшення радіуса атома, а тому зв’язок між Гідрогеном і галогеном послаблюється. Отже, саме в молекулах НІ, які містяться в розчині йодидної кислоти, найлегше відщеплюються йони Гідрогену.
Відомі сполуки галогенів з Оксигеном. Серед оксигеновмісних сполук галогенів стійкими є солі оксигеновмісних кислот (Флуор оксигеновмісних кислот не утворює). У ряду оксигеновмісних кислот, наприклад Хлору: НСlO → НСlO2 → НСlO3 → НСlO4, спостерігається посилення кислотних і зменшення окисних властивостей.
Біологічна роль.
Галогени з ґрунту засвоюються рослинами. З водою та кормом вони потрапляють до організму тварин, з харчовими продуктами і водою надходять в організм людини.
Флуор бере участь у забезпеченні нормального стану зубів, кісток, волосся; має вплив на імунну систему, функцію залоз внутрішньої секреції. Нестача Флуору у питній воді та харчових продуктах виявляється в людини через карієс (руйнування твердої частини зубів), його надлишок пошкоджує зубну емаль. Оптимальним є вміст Флуору в питній воді близько 1 мг/л. Добова потреба людини у Флуорі становить у середньому 2—3 мг і задовольняється в основному питною водою.
Хлор — це компонент тканин рослин, тварин і людини. У складі натрій хлориду бере участь у формуванні плазми крові. Хлоридна кислота у шлунковому соку (0,4—0,5 %) забезпечує необхідну для перетравлення їжі кислотність, запобігає розвитку в шлунку процесів гниття та бродіння, впливу хвороботворних бактерій. Добова потреба людини у Хлорі становить у середньому 3 г.
Іод у складі біологічно активних речовин бере участь в обміні речовин. При дефіциті в організмі Іоду розвивається базедова хвороба і, як наслідок, тяжке захворювання — зоб. Для людини добова потреба в Іоді становить приблизно 0,2 г.
Бром разом з Іодом впливають на функцію щитоподібної залози, у вигляді бромідної кислоти разом із хлоридною — на кислотність шлункового соку.
Потребу в галогенах забезпечують різноманітні харчові продукти (овочі, овочеві консерви, варення, чай, крупи, м’ясо, риба, курячі яйця тощо).
Published: Apr 5, 2022
Latest Revision: Apr 5, 2022
Ourboox Unique Identifier: OB-1307114
Copyright © 2022








