by MAKS
Copyright © 2022
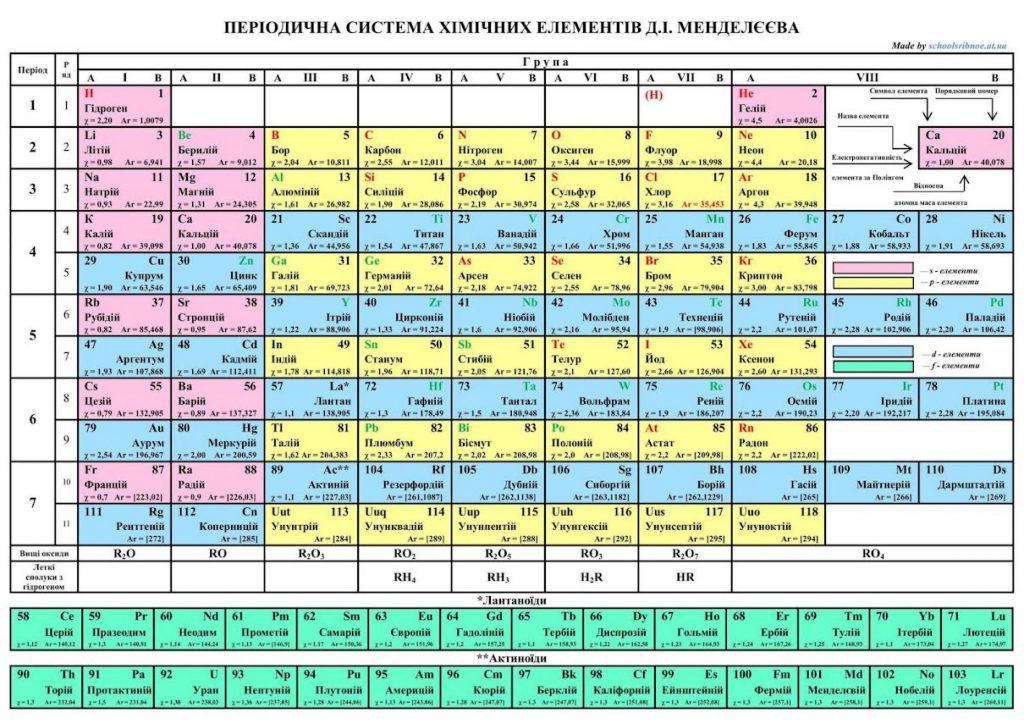
Періодична система хімічних елементів — класифікація хімічних елементів, що встановлює залежність різних властивостей елементів від заряду їхнього атомного ядра. Періодична система хімічних елементів є графічним виразом періодичного закону — який визначає, що властивості хімічних елементів, простих речовин, а також склад і властивості сполук, перебувають у періодичній залежності від значень зарядів ядер атомів. Її початковий варіант, що базувався на періодичній залежності властивостей хімічних елементів від значень атомних мас, був розроблений російським та німецьким хіміками Д. І. Менделєєвим та Лотаром Маєром у 1869—1871 роках[1][2]. За цю розробку у 1882 році обидва хіміки отримали Медаль Деві від Лондонського королівського товариства. Всього запропоновано кілька сотень варіантів зображення періодичної системи (аналітичні криві, таблиці, геометричні фігури і т. ін.). У сучасному варіанті системи передбачається зведення елементів в двовимірну таблицю, в якій кожен стовпець (група) визначає основні фізико-хімічні властивості, а рядки є періоди, в певній мірі подібні один одному.
Загальна характеристика[ред. | ред. код]
Впорядковане за зростанням атомного номера розташування елементів у вигляді таблиці. У комірках періодичної таблиці розміщено інформацію, яка включає символ елемента та атомний номер, крім того там може бути назва елемента національною мовою та атомна маса ізотопів елемента. Порядковий номер елемента при тому відповідає позитивному зарядові атомного ядра, а номер періоду відповідає максимальному головному квантовому числу n. Ряд елементів, які відповідають однаковому максимальному головному квантовому числу n, становлять період.
Такі горизонтальні ряди, розташовані певним чином один під одним, утворюють вертикальні стовпці елементів, що називаються групами, в яких хімічні і фізичні властивості елементів змінюються по вертикалі закономірно. Запропоновані різні формальні представлення періодичної системи елементів, але найпопулярнішим є зображення у вигляді таблиць, яких є три — коротка, довга та дуже довга.
У періодичної таблиці елементів, що представлена у короткому вигляді, довгі періоди розділені на два горизонтальних ряди. Короткі періоди і розділені періоди розташовані один під одним. Вертикальні стовпці становлять групи. Кожна група має дві підгрупи — головну та побічну, а номер групи збігається з кількістю електронів на зовнішньому електронному шарі в атомах елементів перших двох періодів. Елементи головної групи мають однакову кількість валентних електронів і подібні хімічні властивості, які закономірно посилюються чи послаблюються згори вниз у межах групи.
У періодичної таблиці елементів, що називають довгою, періоди безрозривно розташовуються один під одним, утворюючи вертикальні групи, яких налічується 18. Кожна група характеризується однаковим числом електронів на верхніх заповнюваних орбіталях. У кожній такій групі хімічні і фізичні властивості елементів змінюються закономірно по вертикалі. Групи утворюють блоки (s, p, d, f), які відповідають заповненню верхніх s, p, d, f-електронних орбіталей.
Значення періодичної системи[ред. | ред. код]
Періодична система стала важливою віхою у розвитку атомно-молекулярного вчення. Завдяки їй склалося сучасне поняття про хімічний елемент, були уточнені уявлення щодо простих речовин і сполук.
Розроблена у XIX ст. у рамках науки хімії, періодична таблиця виявилася готовою систематизацією типів атомів для нових розділів фізики, що отримали розвиток на початку XX ст. — фізики атома та фізики ядра. У ході досліджень атома методами фізики було встановлено, що порядковий номер елемента у періодичній таблиці (атомний номер) є мірою електричного заряду атомного ядра цього елемента, номер горизонтального ряду (періоду) у таблиці визначає кількість (частково) заповнених електронних оболонок атома, а номер вертикального ряду — квантову структуру зовнішньої оболонки, завдяки чому елементи цього ряду і зобов’язані подібністю своїх хімічних властивостей.
Поява періодичної системи відкрила нову наукову еру в історії хімії та ряді суміжних наук — замість розрізнених відомостей про елементи та сполуки з’явилася струнка система, на основі якої стало можливим узагальнювати, робити висновки, передбачати.
Published: Apr 5, 2022
Latest Revision: Apr 5, 2022
Ourboox Unique Identifier: OB-1307223
Copyright © 2022








