
Згадаємо вивчену тему. Виконайте завдання.
2
3
Кислоти – це неорганічні сполуки, що складаються з катіонів Гідроґену, здатних заміщуватись катіонами металічних елементів або NH4+, та аніонів кислотного залишку.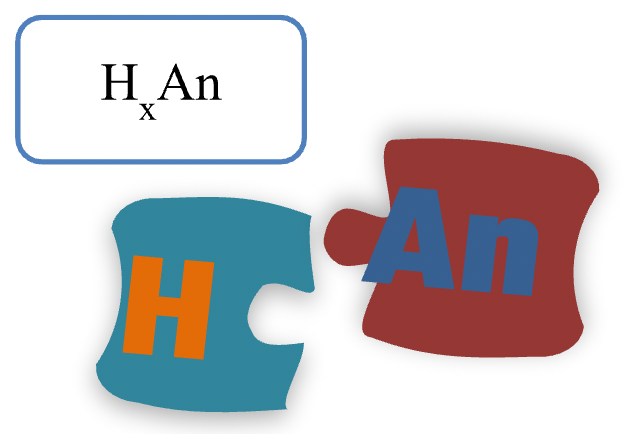

4
Фізичні властивості кислот:
-
Агрегатний стан: зазвичай рідкі, але бувають і газоподібні та тверді.
-
Висока розчинність у воді.
-
Електропровідність у водних розчинах.
-
Низький pH (менше 7).
-
Корозійна активність.
-
Здатність проводити електричний струм у водних розчинах.

5
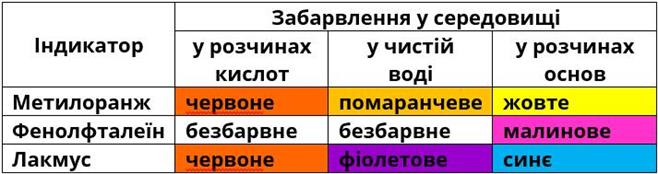
8
9
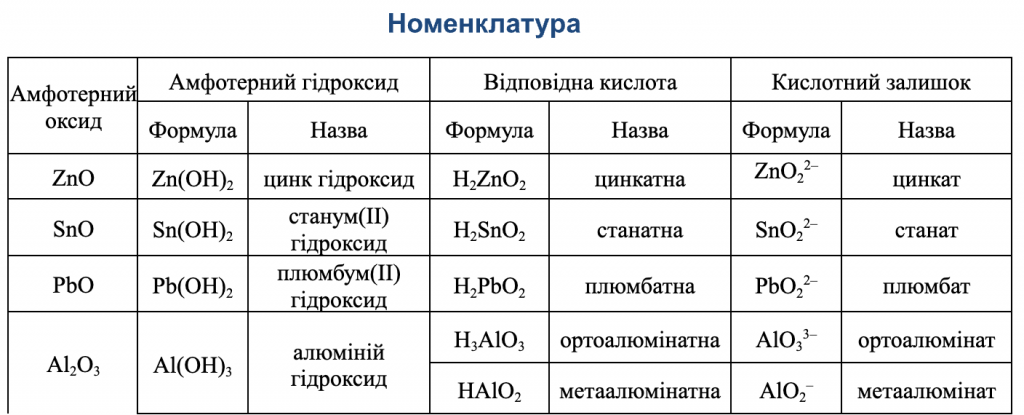
Взаємодія кислот з металами
Кислоти взаємодіють з металами, що стоять в ряду активності металів лівіше водню. В результаті реакції утворюється сіль і виділяється водень. Тобто, метали, що розташовані в ряду активності лівіше, витісняють атоми Гідрогену з кислот.
11

13
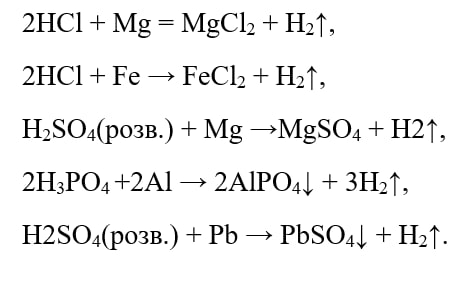
Увага! Нітратна кислота по-особливому реагує з металами. Водень не витісняється жодним із металів.
4Mg + 9HNO3(розв.) → 4Mg(NO3)2 + NH3↑+ 3H2O
Cu + 4HNO3(конц.) → Cu(NO3)2 + 2NO2↑+ 2H2O
15
Концентрована сульфатна кислота, при взаємодії з металами залежно від їх активності, температури середовища, ступеня концентрування кислоти може відновлюватися по-різному. Малоактивні метали відновлюють H2SO4(конц.) до SO2, метали середньої активності – до вільної сірки S0, активні метали – переважно до H2S
2Ag + 2H2SO4(конц.) → Ag2SO4 + SO2↑ + 2H2O,
3Ni + 4H2SO4(конц.) → 3NiSO4 + S + 4H2O,
4Mg + 5H2SO4(конц.) → 4MgSO4 + H2S↑ + 4H2O.
(Al, Cr, Fe, Ti пасивуються)
16
17
Взаємодія кислот з оксидами металі: утворюють середні солі
Наприклад:
2HCl + ZnO → ZnCl2 + H2O
18
19
Взаємодія кислот з основами
Реакція між розчинами кислот і основ називається реакцією нейтралізації.
20
21
Взамодія кислот з солями
Кислоти реагують з солями, якщо внаслідок реакції випадає осад, виділяється газ чи утворюється слабкий електроліт.
H2SO4 + BaCl2 → BaSO4↓ + 2HCl,
2HNO3 + CaCO3→ Ca(NO3)2 + CO2 + H2O,
HCl + NaNO2 → HNO2 + NaCl
22
23
24

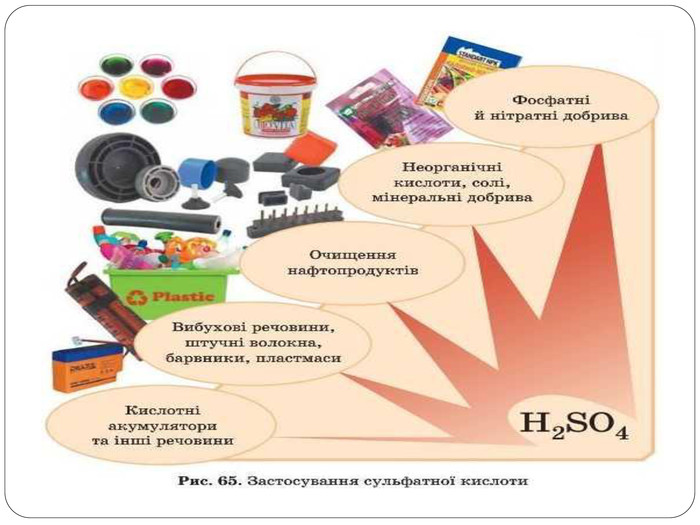
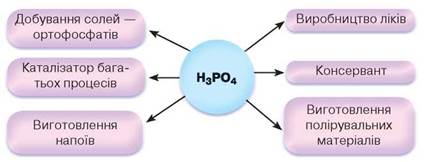
Використання найпоширеніших неорганічних кислот
26


Published: Oct 7, 2024
Latest Revision: Dec 17, 2024
Ourboox Unique Identifier: OB-1616594
Copyright © 2024










